
LAS REACCIONES EXOTERMICAS Y ENDOTERMICAS:
TEORÍA DEL COMPLEJO ACTIVADO Y DE LAS COLISIONES
La química es la ciencia que estudia las diferentes formas y estructuras de la materia, sus propiedades, los procesos de transformación de la misma. Uno de los temas más importantes en la química son las reacciones químicas.
Las reacciones químicas durante su proceso de reacción necesitan de cierta cantidad de energía para formar los productos, es decir, se clasifican de acuerdo a si libera o necesita energía calórica, en otras palabras, son endotérmicas cuyo proceso de reacción necesita absorber energía para lograr romper los enlaces entre los átomos, los cuales se reorganizan para así obtener los productos. Además, las reacciones endotérmicas contienen una energía menor en sus reactivos, por lo que se necesita suministrar la suficiente energía del entorno para que la reacción logre formar los productos. (Ver imagen 1)

Imagen 1. Reacciones Endotérmicas
Por el contrario, las reacciones exotérmicas son aquellas que durante su proceso de reacción liberan la energía para así obtener los productos, esto ocurre principalmente en las reacciones de oxidación, también en los procesos de condensación y solidificación del agua. En una reacción exotérmica la energía que contienen los reactivos es mayor que la requerida en la formación de los productos, por esta razón la energía no utilizada se libera. (Ver Imagen 2)

Imagen 2. Reacciones Exotérmicas
Todo lo anterior nos conlleva a la formación, los cuales a través de los años se establecieron dos teorías que tratar de explicar cómo interaccionan los reactantes de una reacción para formar productos. Estas son la teoría del complejo activado y la teoría de colisiones.
La teoría del complejo activado se da cuando las moléculas de los reactivos se aproximan experimentando así una deformación por la alta energía, la cual es de corta duración, es decir, el complejo activado es un estado intermedio de alta energía y corta duración. Para que ocurra el complejo activado se debe tener la suficiente energía de activación, en otras palabras, es la energía adicional que necesitan adquirir las moléculas de los reactivos, para que al colisionar lleguen a formar el complejo activado. (Ver imagen 3)

Imagen 3. Complejo Activado
La teoría de las Colisiones se basa en que durante una reacción química para que se pueda obtener los productos deben colisionar los átomos reactantes para que ocurra una reacción, durante el momento del impacto se rompen los enlaces de los átomos de los reactivos para luego reorganizarme dando origen al producto. Además, para que dichas colisiones sean efectivas, se debe tener ciertos parámetros o condiciones, entre estos están la orientación y energía suficiente de activación. (Ver Imagen 4)
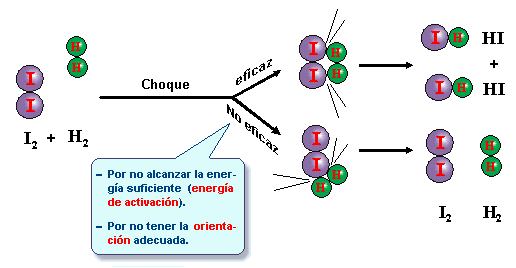
Imagen 4. Colisión eficaz y no eficaz
Para concluir se puede decir que tanto la teoría del complejo activado como la teoría de colisiones nos permite explicar cómo interaccionan los reactantes de una reacción para formar productos.
